Контрольные работы, курсовые, дипломные, рефераты, а также подготовка докладов, чертежей, лабораторных работ, презентаций и еще много всего. Недорого и быстро.
Различия и сходство
Перед тем как в одном из последующих
разделов обратиться к еще одному металлу из группы щелочноземельных — бериллию, остановимся вкратце на свойствах, техническом получении и применении уже рассмотренных щелочных и щелочноземельных металлов.
Щелочноземельными металлами мы называем (наряду с бериллием) магний, кальций, стронций, барий и радий, хотя "строгая" химическая номенклатура относит к этой группе лишь четыре металла — от кальция до радия.
Все эти металлы химически неблагородны, т.е. обладают повышенной способностью вступать в реакции, поэтому не существуют в природе в элементарном состоянии. Натрий, калий, магний и кальций по распространенности в земной коре входят в первую десятку элементов. Да и литий, доля которого в земной коре составляет 65 г/т, распространен гораздо больше, чем азот (46 г/т), олово (40 г/т), свинец (16 г/т),ртуть (0,5 г/т) и золото (0,005 г/т).
Щелочные металлы, кроме цезия, обладают серебристо-белым металлическим блеском; цезий же в чистом состоянии имеет золотисто-желтый цвет. Во влажном воздухе эти металлы сразу покрываются коркой гидроокиси, поэтому их хранят в керосине. Налет гидроокиси появляется на воздухе и у щелочноземельных металлов в местах свежих разрезов или изломов.
Литий, натрий, кальций и стронций в чистом виде получают практически только путем электролиза расплавов. Выделить их из водных растворов невозможно вследствие сильного электроотрицательного характера этих металлов. Они сразу же вступают в реакцию с водой. Чистый литий получают электролизом расплавленной смеси 85-90 % бромида лития и 15-10 % хлорида лития при температуре 520°С. Технический натрий получают электролизом расплавленного хлористого натрия. Точка плавления хлористого натрия высока (8010C), и ее снижают примерно до 6000C добавкой хлористого кальция. Электролитически выделить калий из его гидроокиси или хлорида очень трудно. Поэтому для получения калия применяют термический способ, причем чаще всего в промышленности используют реакцию фтористого калия с карбидом кальция:
2KF + CaC2 = 2К + CaF2 + 2С.
Ячейка Дауна для производства натрия электролизом из расплавленного хлорида: 1 - колокол из железного листа; 2 - расплав NaCl и CaCl2; S - жидкий натрий; 4 - кольцевой катод из железа; 5 "Проволочная сетка (диафрагма); 6 - анод из графита; 7 - хлор
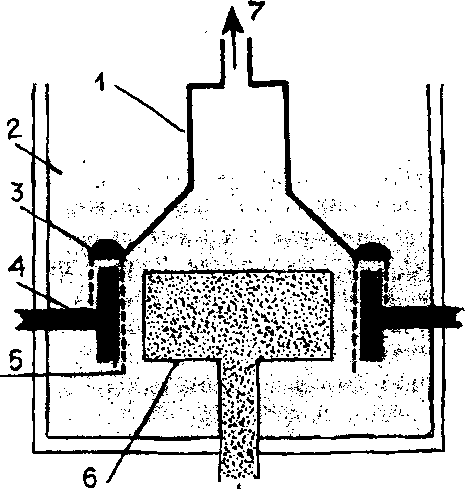
Эта реакция протекает при 1000—HOO0C; выделяющиеся пары калия конденсируют^ полученный металл помещают в керосин.
Магний получают электролизом расплавленного хлорида магния или электротермическим способом (реакцией окиси магния с углем при 20000C). Кальций и стронций проще всего получать электролизом их хлоридов в расплавленном состоянии, а барий предпочтительно получать так называемым алюминотермическим способом из окиси бария при 1200°С:
3BaO + 2Al = 3Ba + Al2 O3.
Цели и масштабы применения рассмотренных в этом разделе металлов очень разнообразны. Бели не считать, что барий и стронций применяются для создания глубокого вакуума в качестве геттеров (газопоглотителей), то значение этих металлов в современной технике сравнительно невелико. То же практически относится и к калию. Он имеет высокую реакционную способность, поэтому с ним трудно работать; обычно его заменяют более дешевым и безопасным в обращении натрием. Металлический натрий применяется весьма широко. Во-первых, он служит сырьем для получения технически важных соединений: амида натрия NaNH2, цианида натрия NaCNn перекиси натрия Na2O2. Во-вторых, его используют в качестве катализатора в реакциях полимеризации и конденсации, для заполнения натриевых ламп и для производства натрийщшковых сплавов. Эти сплавы служат для получения тетраэтилсвинца (ТЭС), добавляемого в топливо для двигателей внутреннего сгорания, чтобы уменьшить детонацию и повысить октановое число топлива. Жидкий натрий можно применять в качестве охладителя для ядерных реакторов. В противораковой медицине используется изотоп натрия с атомной массой 24, полученный нейтронной бомбардировкой обычного натрия.
Магний применяется главным образом в сплавах с алюминием, марганцем, цинком, церием и цирконием. Вследствие небольшой плотности и высокой коррозионной стойкости магниевые сплавы широко используют в двигателях, судо-, авиа- и машиностроении. В органической химии магний находит применение при некоторых процессах синтеза; магниевый порошок в смеси с окислителем иногда применяют и сейчас для освещения в фотографическом деле.
Литий, причисленный к "редким металлам", играет большую роль в современной технике. Он служит для раскисления меди и ее сплавов. Добавка лития в магниевые сплавы (до 10 % по массе) повышает их коррозионную стойкость. Литийсодержащие алюминиевы сплавы отличаются очень хорошими механическими свойствами и применяются поэтому, в частности, в самолетостроении. Велико значение лития в ядерной технике. Литий — "смешанный" элемент,на 92,5 % он состоит из изотопа 3Li, а на 7,5 % из изотопа % Li. Легкий изотоп служит для получения трития ?H. Тритий в известной степени можно считать главным "действующим лицом" в водородной бомбе. В технически "неудовлетворительном" варианте такой бомбы запал, представляющий собой плутониевую бомбу, вызывает взрыв тритиево-дейтериевой смеси. При взрыве происходит слияние ядер и выделяются огромные количества энергии:
^H+ 3iH-*2He + 2n + G,
iH + fH-^He + n + e.
В бомбах такого типа дейтерий и тритий находятся в жидком состоянии. Поэтому "мокрую" водородную бомбу необходимо держать в глубоком холоде. "Сухая" же бомба заполнена твердым дейтеридом лития 6 Li2H, который и является взрывчатым веществом. Такие бомбы легче изготовлять и можно хранить сколь угодно долго. При взрыве дейтерида лития с помощью плутониевой бомбы протекают следующие реакции:
^Li+ 2H-^He, (1)
fU + n-^He + ^H, (2)
fli+^H-* 2^He +п. (3)
В этом случае тритий образуется при взрыве по реакции (2). Требуемые для протекания реакции нейтроны получаются при расщеплении атомов плутония. Полученный тритий реагирует с литием-6 с образованием гелия.
При слиянии ядер выделяется значительно больше энергии, чем при расщеплении атомов. Это ставит перед исследователями сложную и очень ответственную задачу. Если бы удалось в течение длительного времени управлять процессами, происходящими при слиянии ядер, то перед человечеством открылись бы громадные резервы энергии. Однако достичь этой цели пока очень трудно. Требуются большие усилия ученых и инженеров, чтобы эта возможность производства энергии стала явью. И никогда не следует забывать, что к этому источнику энергии нельзя допускать бездумных деятелей, способных уничтожить весь мир в пламени ядерного'взрыва.
|
Вы находитесь на сайте Xenoid v2.0: |
|
Copyright © 2005-2013 Xenoid v2.0
Использование материалов сайта возможно при условии указания активной ссылки
Химия: решение задач